CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
中蒙边境野狼中一株犬细小病毒的鉴定与遗传进化分析
作者:吴后艳 彭勇 王振宝 陶剑 艾军
吴后艳 彭勇 王振宝 陶剑 艾军
摘 要 为探究中国与蒙古国边境地区犬细小病毒(Canine Parvovirus,CPV)流行株和病毒株遗传变异进化情况,从中蒙边境地区收集到14份狼组织样品,经处理后初步利用荧光PCR检测,将检测结果为阳性的样品针对CPV的VP2基因片段进行聚合酶链式反应(Polymerase Chain Reaction,PCR)扩增并测序,利用分子生物学软件(MegAlign Pro、 MEGA7.0)分析核苷酸序列同源性和构建遗传进化树。结果显示,从14份样品中检测到阳性样品12份,经PCR扩增到609 bp的单一条带;核苷酸序列同源性显示,该毒株与5株中国株(NCBI基因登录号:MN840830、MK332007、MZ614964、MK388674、MG013448)的核苷酸同源性最高为98.3%;CPV系统进化分析结果也显示,流行株与上述5株中国株的亲缘关系较近。经CPV序列比对结果及进化分析,最终认为CPV流行株为CPV-2c型。这一结果为中蒙边境地区了解CPV的流行情况和预防CPV进一步传播提供了参考依据。
关键词 犬细小病毒;分离鉴定;系统进化分析
Identification and Genetic Evolution Analysis of a Canine Parvovirus Strain in Wild Wolves on the Sino-Mongolia Border
WU Hou-Yan 1 PENG Yong 2 WANG Zhen-Bao 3 TAO Jian 1* AI Jun 4*
Abstract In order to explore the epidemic strain and genetic variation evolution of Canine Parvovirus (CPV) in the border area between China and Mongolia, 14 wolf tissue samples were collected from the China-Mongolia border area, and the samples with which tested positive were amplified using polymerase chain reaction (PCR) and sequenced targeting the VP2 gene fragment of CPV following fluorescence-based PCR detection. Molecular biology software such as MegAlign Pro and MEGA7.0, was utilized to analyze nucleotide sequence homology and construct genetic and evolutionary trees. The results indicated that 12 out of the 14 samples tested positive and were amplified to produce a single band of 609 bp by PCR. The nucleotide sequence homology revealed that this strain had the highest homology with five Chinese strains (NCBI accession numbers: MN840830, MK332007, MZ614964, MK388674, and MG013448). The results of CPV phylogenetic analysis also showed that the circulating strains were closely related to the above five Chinese strains. Based on the results of CPV sequence comparison and evolutionary analysis, it was finally concluded that the CPV epidemic strain was CPV-2c. This result provides theoretical information for understanding the prevalence of CPV and preventing further spread of CPV in the border areas of China and Mongolia.
Keywords canine parvovirus; isolation and identification; phylogenetic analysis
基金项目:野生动物重要病原跨境传播风险分析、监测预警及示范作用(2022YFC2601605)
第一作者:吴后艳(1999—),女,汉族,云南文山人,硕士,主要研究方向为野生动物及生态圈病原体监测工作,E-mail: 3022716589@qq.com
通信作者:陶剑(1973—),男,汉族,云南红河人,博士,副教授,主要从事生物学、医学教育与医学边缘学科研究工作,E-mail: kmtaojian@sina.com
共同通信作者:艾军(1977—),男,汉族,山西柳林人,博士,研究员,主要从事外来动物疫病检测技术研究工作,E-mail: 52563122@qq.com
1. 昆明学院医学院 昆明 650214
2. 瑞丽海关综合技术中心 瑞丽 678600
3. 伊宁海关技术中心 伊宁 835008
4. 昆明海关技术中心 昆明 650200
1. School of Medicine Kunming University, Kunming 650214
2. Integrated Technology Center of Ruili Customs, Ruili 678600
3. Technology Center of Yining Customs,Yining 835008
4. Technology Center of Kunming Customs, Kunming 650200
犬细小病毒(Canine Parvovirus,CPV)属细小病毒科(Parvoviridae)细小病毒属(Parvovirus),其基因组为相对简单的单链负线性DNA,长度约为5 kb[1-2]。犬细小病毒与猫细小病毒(Feline Parvovirus,FPV)、水貂肠炎病毒(Mink enteritis virus,MEV)和浣熊细小病毒(Raccoon Parvovirus,RPV)一同被列入猫泛白细胞减少症病毒(Feline Panleucopenia Virus,FPV)[3]。CPV在自然界分布非常广泛,具有高致病性和高传染性,是犬科动物最常见的、危害最严重的一种急性传染病,是犬的第二大传染病,目前接种疫苗是预防CPV感染和犬内传播的最有效措施[4]。临床上以出血性肠炎和非化脓性心肌炎两种病型为特征,易感染幼犬,典型的临床表现包括呕吐、发热、腹泻、脱水、呼吸受阻、白细胞减少[5]。该病毒在传播方面没有表现出明显的季节性,但在4—9月有较高的发病率[6]。犬在感染CPV后较难治愈,且治疗期长、费用高。Mazzaferro[7]研究表明,感染CPV后即使预后良好的犬仍可以长时间向外界环境传播病毒,成为潜在的接触源。因此,研究CPV的流行特点及遗传变异规律对今后研究CPV的变异及开展、制定有效的疾病防控策略具有重要意义。
CPV是狗中发现的第二种细小病毒,因此目前所提及的CPV一般是指CPV-2。CPV-1是指犬微小病毒(Minute Virus of Canine,MVC),是1967年美国学者Binn等[8]首先于犬体内分离并命名。CPV-2经过多次的基因变异演化出了多个亚型,这些亚型在全球范围内分布,并且在不同地区的流行情况有所不同。目前,CPV在世界范围内广泛传播,并迅速变异出现新基因型毒株,从CPV发现至今不断有新的基因型和变异位点出现。CPV-2a、CPV-2b及CPV-2c变异株已经取代了最初的CPV-2型毒株,与CPV-2相比,这三种突变体对犬具有更高的致病性,且宿主范围更广[9-11]。根据文献报道,不同基因型的犬细CPV呈地域性流行特征,CPV-2a主要在澳大利亚、印度、匈牙利、韩国、中国和希腊等国家流行,并取代了美国的CPV-2型毒株;CPV-2b在美国、英国和日本等国家流行;CPV-2c主要在意大利、阿根廷和乌拉圭被检测到,在美洲和欧洲的一些国家也具有较高的流行率[12]。在我国,梁士哲等[13]于1982年最早从腹泻的狗粪便中检出细小病毒样颗粒,首先发现了类似CPV所致犬出血性肠炎的病例,随后在1983年由徐汉坤[14]正式报道并确认了CPV在我国境内的流行情况。从犬细小病毒在我国发现至今,几十年间CPV发生了多次遗传和抗原变异,目前已知CPV-2a、CPV-2b、CPV-2c、New CPV-2a、和New CPV-2b变异株在国内均有流行[15]。
本文通过了解中蒙边境地区CPV流行株的遗传进化情况,对采集样品所得到的CPV毒株进行鉴定并分析其遗传变异规律,为中蒙边境地区CPV的防治提供参考。
1 材料与方法
1.1 材料
1.1.1 样品来源
于2024年在中国与蒙古国边境地区采集狼的肝、脾组织各7份样本。将采集到的狼组织样本于-20℃下储存,以保持其完整性。
1.1.2 主要试剂
病毒DNA/RNA提取试剂盒(西安天隆科技有限公司);ACEQ U+ Probe Master Mix(南京诺唯赞生物科技有限公司);Premix TaqTM(TaQaRa TaqTM Version2.0 plus dye)(宝日医生物技术(北京)有限公司)。
1.1.3 主要仪器
超声波破碎仪(MS-100,日本股份有限公司);全自动核酸提取仪(NP968-C,西安天隆科技有限公司);荧光定量PCR仪(TIANLONG,西安天隆科技有限公司);PCR扩增仪(ETC811,北京东胜创新生物科技有限公司);水平电泳槽(WIX-midDNA,北京韦克斯科技有限公司);凝胶成像系统(BLT-5000 Pro Ⅱ,上海雷磁公司)。
1.1.4 引物及探针
CPV实时荧光PCR引物及探针参照标准SN/T 3984—2014《犬细小病毒实时荧光PCR检疫技术规范》设计合成,PCR引物参照GB/T 27533—2011《犬细小病毒病诊断技术》标准设计合成。所有引物及探针序列(表1)由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 犬细小病毒荧光PCR扩增
将采集的组织样品置于2 mL研磨管中,加入1 mL 1×PBS(pH 7.4)2 mL使用研磨机充分研磨,制成悬液,4℃浸毒过夜。次日以5000 r/min离心10 min,取上清液备用。采用酸提取试剂盒(磁珠法)提取病毒核酸。利用表1中的CPV-1引物和探针以提取的DNA为模板进行CPV的检测。荧光PCR扩增体系见表2。
表2 CPV荧光PCR扩增反应体系
Table 2 CPV fluorescent PCR amplification reaction system
反应成分 | 用量 (μL) |
2×Ace Q U+ Probe Master Mix | 10 |
50×ROX Reference Dye 1 | 0.4 |
Gene Specific Primer Forward (10 μM) | 1.6 |
Gene Specific Primer Reverse (10 μM) | 1.6 |
TapMan Probe (10 μM) | 0.8 |
模板DNA | 2.0 |
RNase-free ddH2O | Up to 20 |
反应程序:37℃污染消化2 min;然后95℃预变性5 min,循环反应95℃ 10 s,60℃退火30 s,共进行45次循环。
1.2.2 犬细小病毒PCR扩增
以表1中的CPV-2为引物,采用磁珠法提取6份1.2.1中检测结果阳性较强样品的核酸为模板进行PCR扩增。扩增体系:Premix Taq (TaKaRa TaqTM Version 2.0 plus dye)25 μL、上游引物1 μL、下游引物1 μL、灭菌蒸馏水20 μL、模板DNA 3 μL。反应程序:94℃ 30 s;55℃ 30 s;72℃ 40 s;共扩增30个循环。待PCR反应结束后,利用1.5%琼脂糖凝胶,在电泳仪中150 V 20 min进行电泳。将结束电泳的琼脂糖凝胶放入凝胶成像系统中进行观察是否有符合大小的单一条带。
1.2.3 犬细小病毒遗传进化分析
将1.2.2中 CPV的PCR扩增产物利用胶回收试剂盒回收后送至测序公司,将测序回来结果在国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中比对,并从NCBI创建的GenBank核酸数据库获取了16株CPV参考毒株序列和6株FPV参考毒株序列(表3),用MegAlign Pro软件进行核苷酸同源性分析,并用 MEGA 7.0软件Maximum-Likelihoodo法(Bootstrap 参数设置为1000次)构建遗传进化树,分析该流行株与其他参考毒株之间的进化关系。
表3 16株CPV与6株FPV参考毒株信息
Table 3 Information on 16 reference strains of CPV and 6 reference strains of FPV
基因登录号 | 毒株亚型 | 毒株分离国家 | 毒株分离年份 |
M24003.1 | CPV-2a | 美国 | 1993 |
MG013488.1 | CPV-2c | 中国 | 2018 |
MK388674.1 | CPV-2c | 中国 | 2020 |
EF011664.1 | CPV-2a | 中国 | 2011 |
MZ614964.1 | CPV-2c | 中国 | 2022 |
FJ222821.1 | CPV-2c | 意大利 | 2009 |
MN840830.1 | CPV-2c | 中国 | 2020 |
MK332007.1 | CPV-2c | 中国 | 2019 |
MN451688.1 | - | 美国 | 2019 |
KT382542.1 | CPV-2a | 中国 | 2018 |
JQ268284.1 | CPV-2b | 中国 | 2017 |
MN451689.1 | - | 美国 | 2019 |
M19296.1 | - | - | 1995 |
M12998.1 | - | - | 1993 |
MN451695.1 | - | 美国 | 2019 |
D26079.1 | - | 日本 | 2008 |
KX685354 | FPV | 中国 | 2017 |
KT240130 | FPV | 葡萄牙 | 2008 |
KP280068 | FPV | 中国 | 2014 |
MF541138 | FPV | 中国 | 2018 |
MK266787 | FPV | 中国 | 2017 |
MT614366 | FPV | 中国 | 2019 |
2 结果
2.1 犬细小病毒PCR鉴定结果
采用探针法并利用表1中的CPV通用荧光引物和探针对样品初步筛选,荧光PCR鉴定结果(图1)显示,鉴定的14份样品中有12份样品(85.7%)呈CPV阳性,且阴性对照无扩增曲线,因此初步判断为犬细小病毒感染。进一步用表1中CPV-2对6个经检测阳性较强的样品进行PCR鉴定(图2)。琼脂糖凝胶电泳显示,6份所选样品的DNA模板均能扩增出符合预期大小的609 bp单一条带,且阴性对照无条带。
图1 组织样品荧光PCR鉴定结果
Fig.1 Fluorescent PCR identification results of specimens
M: DL 2000 DNA Marker; 泳道1—6: 检测样品; 泳道7: 阴性对照
图2 病毒的PCR鉴定结果
Fig.2 PCR identification results of virus
2.2 犬细小病毒分型鉴定与遗传进化分析
与16株(8个国内株和8个国外株)CPV参考毒株和6株FPV参考毒株核苷酸同源性分析显示,分离毒株基因组序列与国外毒株的同源性为96.2%~97.9%,与国内毒株同源性97.7%~98.3%,与FPV毒株的同源性为95.7%~96.2%(图3)。由系统发育树(图4)可见,分离所得病毒株与近7年来我国各地分离得到的毒株同处于一个大分支内,亲缘关系较近,而与国外毒株的亲缘关系较远。此外,根据图4发育树可知,FPV与CPV处在一个分支,二者有较近的亲缘关系。
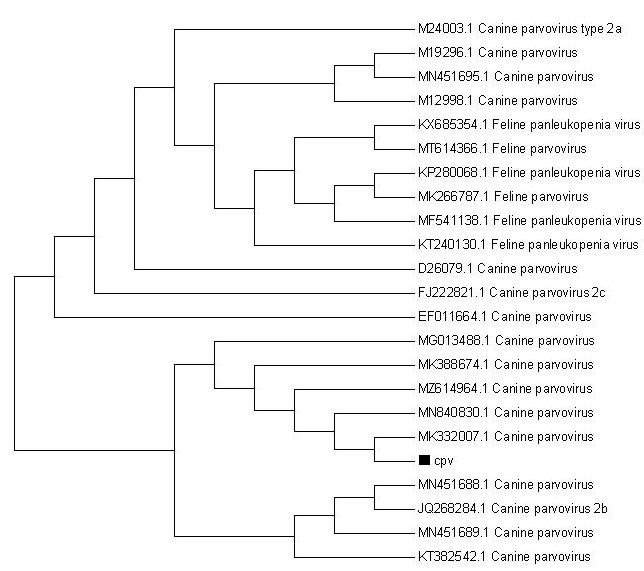
图4 CPV毒株核苷酸序列系统发育树
Fig.4 Phylogenetic tree of nucleotide sequences of CPV strains
3 讨论
本研究从中蒙边境地区狼的肝、脾组织样本中监测到CPV-2c亚型毒株,该亚型于2010年在我国吉林首次发现,此后在我国广西、北京等地均监测到CPV-2c亚型,CPV-2c型毒株的检出率呈上升趋势[16-17]。本次试验结果与CPV毒株在中国的流行趋势相同。CPV基因组包含两个主要开放阅读框(Open Reading Frames,ORF),分别编码两个非结构蛋白(NS 1和NS 2)和一个衣壳蛋白(VP 1和VP 2)[18]。后来有研究报道称CPV病毒颗粒中还存在VP 3蛋白质,它是通过VP 2的蛋白水解加工而产生[19]。VP 1和VP 2两种结构蛋白通过相同的mRNA选择性剪接构成,具有良好的抗原性,与感染宿主范围、病毒趋向性和病毒与宿主相互作用有关[20]。其中,VP 2基因包含了主要的抗原决定簇,以及决定感染宿主范围的关键位点和与宿主细胞膜上细胞转铁蛋白受体(Transferrin Receptor,TfR)结合的位点,是衣壳蛋白的重要组成部分[21]。有研究表明,CPV与宿主细胞TfR的亲和能力决定了CPV感染宿主的范围,但其传播机制尚未明确,有待进一步研究[22]。
在2010年之前,我国未见CPV-2c、new CPV-2a和new CPV-2b的相关报道,随着分子生物学的发展和研究的深入,从2010年开始发现了更多的CPV变异。到2014年和2015年,我国的new CPV-2a和CPV-2a已经在总数量上大致相同,这提示new CPV-2a型在我国已经成为部分省份的主要变种[23]。本次研究从中蒙边境地区野狼组织中鉴定出CPV,遗传进化分析显示该毒株为CPV-2c亚型,未来可能会有更多关于的CPV变种报道,包括new CPV-2a、new CPV-2b和CPV-2c等亚种。
CPV由FPV部分氨基酸位点发生突变而来,有研究表明CPV和FPV的基因序列同源性仅相差约1%[24],FPV的变异速率较慢,而CPV基因组的替代率更接近RNA的水平,这就是 CPV 第一次出现时并不会感染猫,而由于随后其VP 2发生突变,使得CPV获得了在猫身上感染和复制的能力,扩大了宿主范围的原因[25]。CPV可通过粪便-口腔途径直接或间接接触传播[26]。直接传播途径是与患病宿主的排泄物接触后造成感染,间接传播则是通过患病宿主的排泄物污染食物、饮用水以及周围环境后引发感染,从而导致家养或野生食肉动物受到该病毒的影响。同时,CPV的遗传变异会使宿主范围不断扩大,并成为新的具有以前宿主物种抗性的广泛病原体。据文献报道,CPV可感染多种物种,如郊狼、灰狼、美洲狮、浣熊、食鱼动物、山猫、河獭、红狐、灰狐、猫鼬等,并且在郊狼、灰狼、美洲狮等肉食性动物中出现较高的感染率[22]。因此,在有家养犬类和野生动物接触的地区,CPV可在野外经历持续的继续传播,这种跨物种传播可能对生态传播和对野生动物物种的保护产生影响。
本研究从中蒙边境地区狼组织中监测到CPV-2c亚型毒株感染,遗传进化分析发现该毒株与国内毒株有较高的亲缘关系,但不同地区的CPV流行株存在一定的差异,这可能是随着宿主范围的变化不断进化和适应的结果。鉴于CPV可通过粪便向环境中长期排毒并长时间保持活性,在出现CPV区域的地区做好病毒消杀工作,防止病毒的进一步传播是至关重要的。随着CPV的不断传播及其基因的变异,未来CPV可能会出现新的变异株,因此要持续对中蒙边境地区CPV进行检测和分析CPV的遗传进化规律,为科学、有效地防控CPV感染疾病制定应对措施提供借鉴和参考。后续研究还需进一步对病毒基因组进行深入分析和流行病学研究,以获得病毒在该区域的传播模式、遗传变异情况以及疫苗效果等重要信息,从而为公共卫生和动物保健提供支持。
4 结论
本研究对中蒙边境地区野生动物狼组织样品进行检测,测序出CPV病毒,与NCBI比对分析显示所检测样本中的CPV序列与GenBank中存在的其他CPV序列具有99.81%的序列同源性。对其遗传进化特点分析结果表明,该流行株与NCBI上5株中国分离株(基因登录号:MN840830、MK332007、MZ614964、MK388674、MG013448)亲缘关系较近,处于同一分支,为国内分离株,基因型为CPV-2c。中蒙边境地区野狼中存在细小病毒感染,且该细小病毒为犬科的优势毒株CPV-2c亚型。因此,应加强对中蒙边境地区犬科动物细小病毒感染情况的追踪和监测,并预防该病毒的进一步传播。
参考文献
[1] 张仁舟, 杨松涛, 冯昊, 等. 中国国内首次检测到犬细小病毒CPV-2c[J]. 中国病原生物学杂志, 2010, 5(4): 246-249.
[2] Han S C, Guo H C, Sun S Q, et al. Full-Length Genomic Characterizations of Two Canine Parvoviruses Prevalent in Northwest China[J]. Archives of Microbiology, 2015, 197(4): 621-626.
[3] Priestnall S L, Mitchell J A, Walker C A, et al. New and Emerging Pathogens in Canine Infectious Respiratory Disease[J]. Veterinary Pathology, 2014, 51(2): 492-504.
[4] 王诗研,印春生, 曹众达, 等. 犬细小病毒病防控技术研究进展[J]. 中国兽药杂志, 2024, 58(6): 86-94.
[5] 窦达林. 犬细小病毒病的病原学特性及临床诊断[J]. 吉林畜牧兽医, 2022, 43(5): 98-99.
[6] 刘国. 犬细小病毒病的临床特点及治疗措施[J]. 吉林畜牧兽医, 2022, 43(3): 114-116.
[7] Mazzaferro E M. Update on Canine Parvoviral Enteritis[J]. Veterinary Clinics of North America-Small Animal Practice, 2020, 50(6): 1307-1325.
[8] Binn L N, Lazar E C, Eddy G A, et al. Recovery and Characterization of a Minute Virus of Canines[J]. Infection and Immunity, 1970, 1(5): 503-508.
[9] Ikeda Y, Mochizuki M, Naito R, et al. Predominance of canine parvovirus (CPV) in unvaccinated cat populations and emergence of new antigenic types of CPVs in cats[J]. Virology, 2000, 278(1): 13-19.
[10] Martella V, Decaro N, Elia G, et al. Surveillance activity for canine parvovirus in Italy[J]. Journal of Veterinary Medicine Series B: Infectious Diseases and Veterinary Public Health, 2005, 52(7-8): 312-315.
[11] Mochizuki M, Horiuchi M, Hiragi H, et al. Isolation of canine parvovirus from a cat manifesting clinical signs of feline panleukopenia[J]. Journal of Clinical Microbiology, 1996, 34(9): 2101-2105.
[12] Qi S, Zhao J, Guo D, et al. A Mini-Review on the Epidemiology of Canine Parvovirus in China[J]. Frontiers in Veterinary Science 2020, 7: 5.
[13] 梁士哲, 魏喜仁, 范文光, 等. 狗传染性肠炎的研究1、腹泻狗粪便中检出的细小病毒样颗粒[J]. 上海畜牧兽医通讯, 1982(4): 172-175.
[14] 徐汉坤. 犬细小病毒性肠炎[J]. 畜牧与兽医, 1983(1): 29-31.
[15] 张爱国, 温良海, 陈廷毅, 等. 郑州地区犬细小病毒VP2基因遗传进化分析[J]. 现代牧业, 2024, 8(1): 1-7.
[16] 孔繁丽, 卢曾军, 陈慧丽, 等. 犬源细小病毒兰州株的分离鉴定与VP2基因的遗传进化分析[J]. 西北农业学报 , 2024, 33(11): 2011-2019.
[17] 由海波, 韩志强, 史赫, 等. 犬细小病毒的遗传变异及流行情况分析[J]. 中国动物传染病学报, 2020, 28(6): 113-118.
[18] Parrish C R. Host range relationships and the evolution of canine parvovirus[J]. Veterinary Microbiology, 1999, 69(1-2): 29-40.
[19] Touihri L, Bouzid I, Daoud R, et al. Molecular characterization of canine parvovirus-2 variants circulating in Tunisia[J]. Virus Genes, 2009, 38(2): 249-258.
[20] Callaway H M, Feng K H, Lee D W, et al. Parvovirus Capsid Structures Required for Infection: Mutations Controlling Receptor Recognition and Protease Cleavages[J]. Journal of Virology, 2017: 1816-1871.
[21] Govindasamy L, Hueffer K, Parrish C R, et al. Structures of host range-controlling regions of the capsids of canine and feline parvoviruses and mutants[J]. Journal of Virology, 2003, 77(22): 12211-12221.
[22] Allison A B, Kohler D J, Ortega A, et al. Host-Specific Parvovirus Evolution in Nature Is Recapitulated by In Vitro Adaptation to Different Carnivore Species[J]. Plos Pathogens, 2014, 10(11): e1004475.
[23] Zhuang Q, Qiu Y, Pan Z, et al. Genome sequence characterization of canine parvoviruses prevalent in the Sichuan province of China[J].Transboundary and Emerging Diseases, 2019, 66(1865-1674): 897-907.
[24] Ahmed N, Riaz A, Zubair Z, et al. Molecular analysis of partial VP-2 gene amplified from rectal swab samples of diarrheic dogs in Pakistan confirms the circulation of canine parvovirus genetic variant CPV-2a and detects sequences of feline panleukopenia virus (FPV)[J]. Virology Journal, 2018, 15(1): 45. DOI: 10.1186/s12985-018-0958-y.
[25] Stucker K M, Pagan I, Cifuente J O, et al. The role of evolutionary intermediates in the host adaptation of canine parvovirus[J]. Journal of Virology, 2012, 86(3): 1514-1521.
[26] Chollom S, Fyaktu E, Okwori A, et al. Molecular detection of canine parvovirus in Jos, Nigeria[J]. Journal of Veterinary Medicine & Animal Health, 2013, 5: 57-59.
表1 CPV克隆所需的引物
Table 1 Primers for CPV cloning
引物名称 | 引物序列 | 扩增片段大小 (bp) |
CPV-1F | GGCCTGGGAACAGTCTTGAC | - |
CPV-1R | GCGAAGATAAGCAGCGTAAGC | |
CPV-1P | FAM-CCAACTAACCCTTCTGACGCCGCTG-TAMRA | |
CPV-2F | GAATCTGCTACTCAGCCACCAAC | 609 |
CPV-2R | GTGCACTATAACCAACCTCAGC |
Peroent Identity

Divereenoe
图3 CPV毒株核苷酸同源性分析
Fig.3 A comparative analysis of the nucleotide homology of CPV strains







