CopyRight 2009-2020 © All Rights Reserved.版权所有: 中国海关未经授权禁止复制或建立镜像
朱顶红种球中尼润潜隐病毒的检测鉴定
作者:胡佳续 张宇含 刘鹏 康芬芬 刘勇
胡佳续 张宇含 刘鹏 康芬芬 刘勇
摘 要 尼润潜隐病毒(Nerine Latent Virus,NeLV)能够感染多种石蒜科植物,可通过浸染水仙、朱顶红等花卉种球进行远距离传播。本研究根据NCBI已发布的NeLV全基因组序列,设计特异性引物和探针,通过RT-PCR、实时荧光RT-PCR、序列分析等方法,在进口朱顶红种球中检出NeLV,可为加强口岸检疫和相关研究提供参考。
关键词 尼润潜隐病毒;朱顶红种球;RT-PCR;实时荧光RT-PCR;序列分析
Detection and Identification of Nerine Latent Virus
in Imported Hippeastrum Bulb
HU Jia-Xu 1 ZHANG Yu-Han 1 LIU Peng 1 KANG Fen-Fen 1 LIU Yong 1*
Absrtact Nerine latent virus (NeLV) infects a variety of Amaryllidaceae plants and can be disseminated over long distances via infected bulbs of Narcissus, Hippeastrum, and other ornamental geophytes. In this study, we designed specific primers and probes based on the NeLV whole genome sequence published by NCBI, and detected NeLV in Hippeastrum bulbs through the methods of RT-PCR, real-time RT-PCR and sequence analysis. The established assay offers a ready-to-use tool for border quarantine and further virological research.
Keywords Nerine latent virus (NeLV); Hippeastrum bulb; RT-PCR; real-time RT-PCR; sequence analysis
据报道,侵染朱顶红的病毒主要有朱顶红花叶病毒(Hippeastrum Mosaic Virus,HiMV)、黄瓜花叶病毒(Cucumber Mosaic Virus,CMV)、番茄花叶病毒(Tomato Mosaic Virus,ToMV)[1]、朱顶红褪绿环斑病毒(Hippeastrum Chlorotic Ringspot Virus,HCRV)[2]和尼润潜隐病毒(Nerine Latent Virus,NeLV)等。NeLV主要侵染石蒜科植物,寄主植物有水仙、尼润或纳丽石蒜、朱顶红、黄花石蒜等[3],目前在荷兰、英国、美国和中国台湾[4]等国家和地区有分布报道,主要传播途径包括嫁接、根接和修枝,人为运输也是其重要的传播方式之一,这些传播途径都能导致NeLV的扩散和病害蔓延[5-6]。NeLV耐高温,会对感病植株造成系统性侵染,病害初期可能很难观察到明显的症状表现。随着病害的发展,受感染的植株一般会出现生长迟缓、叶片颜色异常(如变黄、褪绿等)、叶片畸形、花朵形态改变或花色异常等症状。由于该病毒具有潜隐性,有时即使植物被感染,也可能在很长一段时间内不会表现出明显的外部症状[7-8],因此在发病后很难防治,给农业生产和观赏植物种植带来了潜在威胁。
NeLV属于乙型线状病毒科(Betaflexiviridae)香石竹潜隐病毒属(Carlavirus)成员。NeLV粒子形态为线状,基因组为正义单链RNA,含有6个开放阅读框,全长8281 nt[4]。目前对于NeLV的检测主要采用以PCR技术为基础的分子生物学方法,包括RT-PCR、荧光PCR和多重荧光PCR技术等,能够比较快速准确地检测感染NeLV的植物样本。2019年,W.A. Monger等[9]利用RT-PCR方法首次在英国发现了尼润潜隐病毒。2020年,陈细红等[10]针对水仙上的水仙普通潜隐病毒(NCLV)和NeLV建立了同时检测并区分2种病毒的双重RT-PCR方法。
我国每年进口大量的花卉种球,如果感染NeLV的种球进入农田或其周边,将造成病害的传播蔓延,因此需要建立检测方法来加强口岸检疫,防止病毒传入。本试验室在前期工作中应用宏基因组测序技术[11],总结文献中针对NeLV的分子检测方法以及NCBI已发布的NeLV最新序列,设计了特异性引物和荧光探针,采用RT-PCR、实时荧光RT-PCR和核酸序列分析等方法,从进口的朱顶红中检出NeLV。本研究对该病毒在朱顶红中的检测方法进行介绍,以期为相关研究提供参考。
1 材料与方法
1.1 材料
样品来源为某批次进口的朱顶红种球,表面无明显症状,从中随机选取10头作为供试样品(编号为2401),纵切种球、剥离鳞片、收集花芽,其余样品放置于4℃保存,如图1所示。
1.2 试剂
核酸提取试剂盒(美国QIAGEN公司);一步法RT-PCR核酸检测试剂盒(大连TaKaRa)。
1.3 仪器
TissueLyser II研磨仪(美国QIAGEN公司);QuantStudio 5实时荧光PCR仪(美国ABI公司);Mastercycler X50 PCR仪(美国Eppendorf公司)。
图1 朱顶红种球及内部花芽形貌图
Fig.1 Morphological diagram of Hippeastrum bulbs and internal flower buds
1.4 植物总RNA提取方法
将朱顶红种球花芽经液氮研磨成粉状,称取100 mg粉末,提取样品总RNA,将提取好的RNA置于-20℃冰箱保存备用。
1.5 引物与探针
根据美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)已发布的NeLV全基因组序列,应用DNAMAN 8.0软件自行设计RT-PCR特异性引物NeLVCP-f/NeLVCP-r及荧光PCR引物NeLV-F/NeLV-R和探针NeLV-P,所有引物和探针均由生工生物工程科技(北京)有限公司合成,见表1。
1.6 RT-PCR扩增
采用一步法RT-PCR检测试剂盒对NeLV外壳蛋白(Capsid Protein,CP)基因进行特异性扩增,预期扩增产物为315 bp,阳性对照样品由本试验室提供,反应体系参照试剂盒说明书。反应程序为:50℃保温30 min;94℃预变性2 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,35个循环。用2%琼脂糖凝胶电泳检测扩增产物。
1.7 实时荧光RT-PCR
实时荧光RT-PCR扩增体系按照一步法RT-PCR检测试剂盒说明书进行配制,反应体系为:Mix(2×)12.5 μL;RNase Free H2O 9 μL;上、下游引物(10 μM)各0.5 μL;荧光探针(10 μM)0.5 μL;2 μL RNA 模板,总体积为20 μL。每个样品设2个平行,同时设置阴性对照(健康朱顶红)与空白对照(去离子水)。
反应程序为:50℃保温10 min,95℃预变性5 min;95℃变性10 s,60℃延伸30 s,共40个循环。用荧光定量PCR仪自带软件对结果进行分析判断,根据阴性对照数值设定检测阈值线,扩增曲线及样品Ct值经软件分析自动生成。
1.8 序列分析及同源性比较
对RT-PCR产物进行克隆测序,由生工生物工程科技(北京)有限公司完成,用DNAMAN 8.0软件将产物序列进行装配拼接,登录NCBI进行序列同源性分析。用MEGA 7.0软件进行序列多重比对,使用最大相似法(Maximum Likelihood Method,ML)构建系统发育树,自举(Bootstrap)检验重复5000次[12]。采用来自亚洲、欧洲、北美洲和大洋洲的NeLV株系用于病毒序列的比较和建树。
2 结果与分析
2.1 RT-PCR检测结果
提取编号2401朱顶红种球样品的总RNA,经过RT-PCR扩增后,经琼脂糖凝胶电泳检测,得到约300 bp的特异片段,与阳性对照长度一致,阴性对照与空白对照无扩增条带(图2),电泳结果表明2401号样品经扩增后为阳性,将此带毒朱顶红种球样品命名为NeLV-2401。
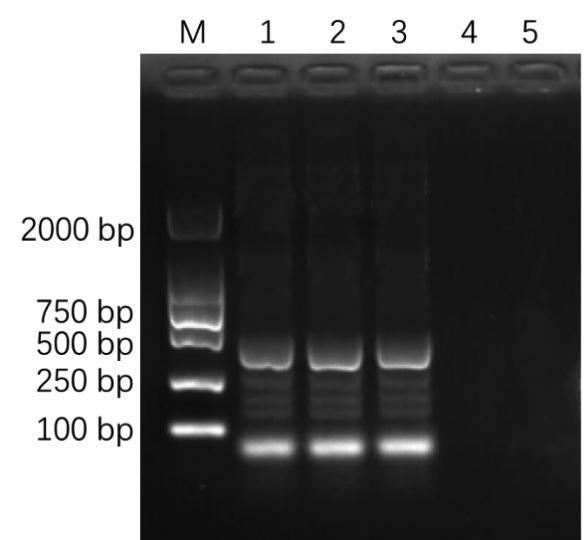
M: Marker DL2000; 1: NeLV阳性对照; 2: 朱顶红种球2401; 3: 朱顶红种球2401重复; 4: 阴性对照; 5: 空白对照
图2 朱顶红种球中NeLV普通RT-PCR检测电泳图
Fig.2 Electrophoresis diagram of common RT-PCR detection of NeLV in Hippeastrum bulbs
2.2 实时荧光RT-PCR检测结果
实时荧光RT-PCR检测结果表明,朱顶红种球2个平行样品(A、B)均有典型的扩增曲线,Ct均值为22。如图3所示,编号1为阳性对照,其Ct值为21,阴性对照和空白对照均无扩增,结果表明该批次朱顶红种球样品中含有尼润潜隐病毒。
2.3 序列分析
将NeLV-2401的RT-PCR产物克隆测序,结果显示该扩增片段含有315个碱基对,碱基G+C的含量为45.4%(图4)。将该序列导入GenBank进行同源性检索,结果表明NeLV-2308与尼润潜隐病毒基因序列相似度均达到93%以上,其中与韩国株系(登录号:LC810167.1)相似度最高,为97.26%,与荷兰株系(登录号:HM119497.1)相似度为96.80%,与德国株系(登录号:OQ731911.1)相似度为96.35%,与中国台湾株系(登录号:KC505177.1)相似度为95.89%,与南非株系(登录号:MT536158.1)相似度为94.06%,而与其他病毒的基因相似度均在70%以下,经序列分析,进一步表明NeLV-2401为尼润潜隐病毒。
2.4 系统发育树的构建和分析
收集已发布的尼润潜隐病毒基因序列,以及同属的豇豆轻型斑驳病毒(Cowpea Mild Mottle Virus)、百合无症病毒(Lily Symptomless Virus)、啤酒花潜隐病毒(Hop Latent Virus)、菊B病毒(Chrysanthemum Virus B),与NeLV-2401的基因序列进行同源性分析,构建系统发育树(图5),基因序列变化强度表现为进化树的分支长度。由构建的系统发育树可以看出,所收集的病毒序列聚为2个大支,NeLV与百合无症病毒亲缘关系较近,聚为1个大支,与其他同属病毒种类距离较远,NeLV-2401与韩国株系、荷兰株系关系最近,聚为1个小分支,进化分析表明NeLV-2401为尼润潜隐病毒。
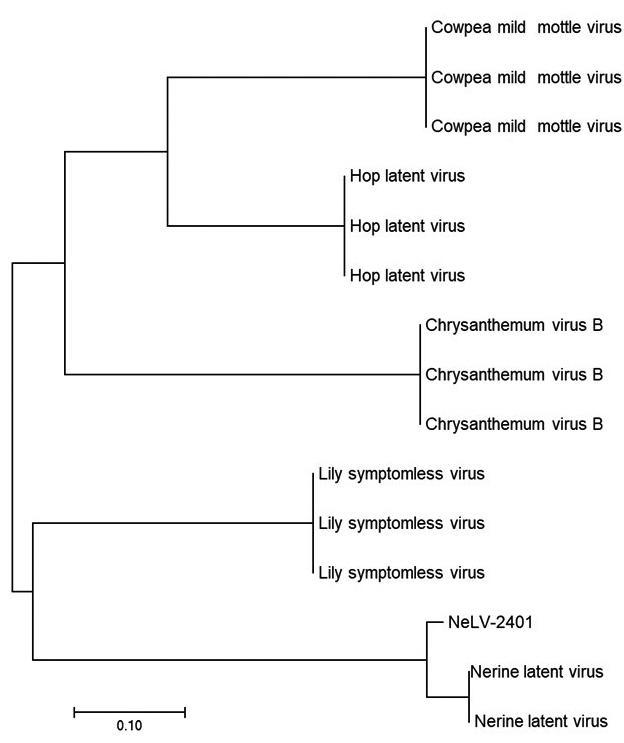
图5 基于NeLV CP基因序列构建的系统进化树
Fig.5 Phylogenetic tree constructed based
on NeLV CP gene sequence
3 结论与展望
近年来,NeLV对朱顶红造成的病害有扩大趋势。然而,国际上尚未有针对该病毒的检疫要求和处置措施,欧洲和地中海植物保护组织(EPPO)、国际应用生物科学中心(CABI)以及国门生物安全基础数据信息资源平台(NBSP)针对该病毒的信息很少,国内外相关文献报道也相对较少,且目前还没有针对该病毒开展有效的风险评估,因此NeLV具有一定的潜在风险。
NeLV侵染寄主后,在病害初期通常表现为隐症,很难从症状上鉴定和区分该病毒,在口岸检疫工作中容易漏检。对此,本研究设计了针对NeLV的RT-PCR和实时荧光RT-PCR的特异性引物和探针,可为日常检测工作提供技术支持。
RT-PCR和实时荧光RT-PCR方法是目前植物病毒检测的常用技术手段,都存在一定的优缺点。其中,RT-PCR方法对于出现与目标片段大小近似的扩增条带需要通过测序的方法来确认,会增加检测时长;实时荧光RT-PCR是目前最主流的植物病毒检测方法,具有特异性强、灵敏度高的优点[13],但容易出现核酸污染,导致假阳性的问题。
近年来,数字PCR技术发展迅速,该技术是对传统PCR技术的升级,可以实现对核酸分子的绝对定量,具有更高的灵敏度和准确性。在植物病毒检测中,数字PCR技术能够检测到极低浓度的核酸,对于早期感染或病毒含量较低的样本具有很好的检测效果,并且能够控制假阳性和假阴性的问题[14],这将是本研究未来进一步探索的方向[15]。
参考文献
[1]王贤, 熊敏, 卫尊征, 等. 朱顶红研究综述[J]. 现代园林, 2014, 11(8): 49-54.
[2] DONG J H, YIN Y Y, FANG Q, et al. A new Tospovirus causing chlorotic ringspot on hippeastrum sp. in China[J]. Virus Genes, 2013, 46(3): 567-570.
[3]我国口岸首次截获尼润潜隐病毒[J]. 农业工程技术(温室园艺), 2013(9): 88.
[4] Jordan R, Wingert M, Louden C, Guaragna M. First report of Nerine latent virus in ornamental Crinum in the United States[J]. Plant Disease, 2018, 102(7): 1469.
[5] Pearson M N, Cohen D, Cowell S J, et al. A survey of viruses of flower bulbs in New Zealand[J]. Australas Plant Pathol, 2009(38): 305-309.
[6] Eun S H, Sun H C. Nerine latent virus diagnosed in Hippeastrum bulbs in Korea[J]. Horticltural Science and Technology, 2021, 39(4): 507-513.
[7] Maat D Z, Huttinga H, Hakkaart F A. Nerine latent virus some propertied and serological detectability in Nerine bowdenii[J]. Neth J Plant Pathol, 1978(84): 47-59.
[8] Wang X, Larrea-Sarmiento A, Olmedo-Velarde A, et al. Complete genome organization and characterization of Hippeastrum latent virus[J]. Virus Genes, 2022(4): 58.
[9] W.A. Monger, R.J. Eden. First report of Nerine latent virus in Haemanthus albiflos in the UK[J]. New Disease Reports , 2019(39): 3.
[10] 陈细红, 蔡伟, 肖颖, 等. 双重RT-PCR快速检测水仙普通潜隐病毒和尼润潜隐病毒[J]. 中国口岸科学技术, 2020(12): 43-47.
[11]董轩瑜, 杨一舟, 张宗英, 等. 利用高通量测序检测朱顶红病毒[C]//中国植物病理学会. 中国植物病理学会2023年学术年会论文集. 中国农业大学植物病理学系农业农村部作物有害生物监测与绿色防控重点试验室. 中国农业大学生物学院, 2023: 403. DOI: 10.26914/c.cnkihy.2023.039018.
[12]王洁, 于维森, 步淑华, 等. DNA条形码在有毒高等陆生植物鉴定和溯源中的应用进展[J].现代预防医学, 2021, 48(3): 435-437+485.
[13]柏自琴,罗会,解璞,等. 火龙果中仙人掌X宾度实时荧光定量PCR检测体系的建立及应用[J].植物保护, 2025, 51(4): 285-289.
[14]王森, 陈东亮, 黄丛林, 等. 基于数字PCR的植物病毒检测技术研究进展[J]. 植物检疫, 2021, 35(3): 1-8.
[15]黄一鸣, 王慧珍, 向国旗, 等. 数字PCR技术在植物病原物检测中的应用[J/OL].中国农业科技导报(中英文), 1-9[2025-09-05]. http://doi.org/10.13304/j.nykjdb.2025.0181.
基金项目:国家重点研发计划项目(2021YFD1400105);海关总署科研项目(2024HK080)
第一作者:胡佳续(1984—),男,汉族,天津人,博士,高级农艺师,主要从事植物病毒检疫工作,E-mail: huhu2544@sina.com
通信作者:刘勇(1972—),女,汉族,天津人,本科,高级农艺师,主要从事杂草检疫工作,E-mail: tjtour@163.com
1. 天津海关动植物与食品检测中心 天津 300457
1. Animal, Plant and Foodstuffs Inspction Center of Tianjin Customs District, Tianjin 300457
表1 检测NeLV的引物与探针
Table 1 Primers and probes for NeLV detection
引物 | 引物序列 (5 '~3 ' ) | 扩增产物 (bp) | 适用技术 |
NeLVCP-f | GGGTCCCACCTGAATCAAT | 315 | RT-PCR |
NeLVCP-r | TTGCTGCTGGGTTCCTTA | ||
NeLV-F | GCAAGTGCTGGTTCTTCAG | 98 | 实时荧光RT-PCR |
NeLV-P | FAM-TCCTCAAGGCACTGTTGA-TAMARA | ||
NeLV-R | TCCTTGATTGTGGCGACA |
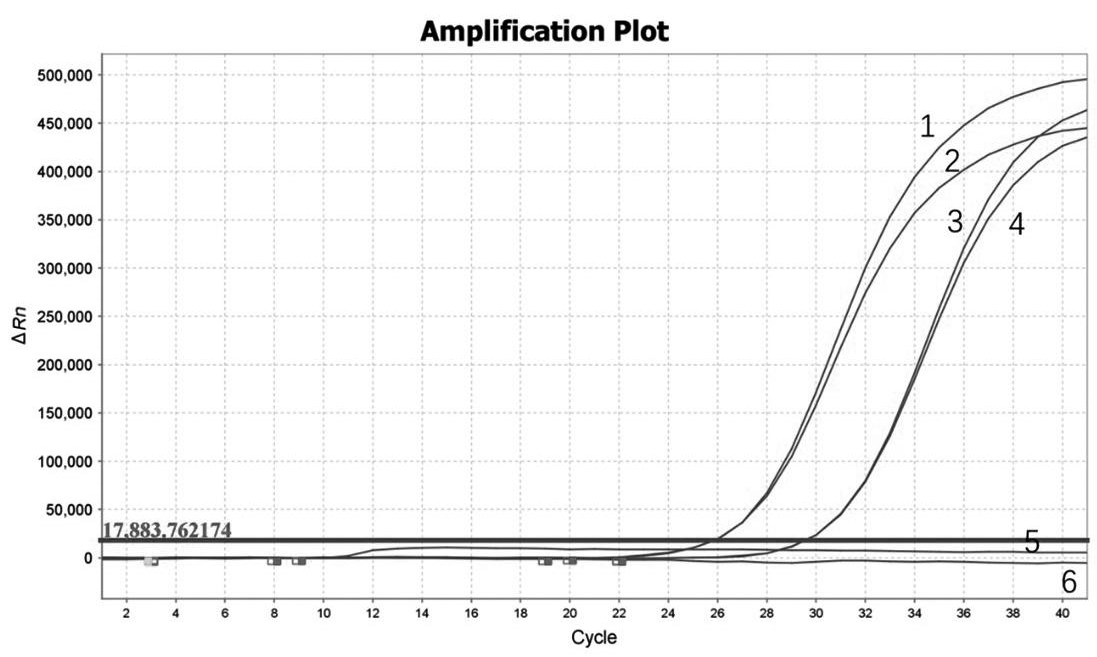 1~2: NeLV阳性对照; 3~4: 编号2401朱顶红种球; 5: 阴性对照; 6: 空白对照
1~2: NeLV阳性对照; 3~4: 编号2401朱顶红种球; 5: 阴性对照; 6: 空白对照
图3 朱顶红种球实时荧光RT-PCR检测结果
Fig.3 Real-time fluorescent RT-PCR test results of Hippeastrum bulbs

图4 NeLV CP-f/NeLV CP-r扩增序列
Fig.4 Amplified sequence of NeLV CP-f/NeLV CP-r







